La bellezza è una. Per i credenti, essa è in fondo l’immagine del volto di Dio nel Creato, ma le forme attraverso cui a noi si mostra sono molteplici e cangianti. La bellezza della fisica e della biologia va ricercata nel loro essere scienze”‘estreme” in un asse ideale che va dalla semplicità alla complessità, dalla ricerca del generale alla frammentazione in miriadi di piccole storie. Dal lato della fisica ammiriamo la stupefacente concisione delle leggi della dinamica di Newton che, come uno scrigno, svelano una favolosa molteplicità di applicazioni, dalla dinamica molecolare delle proteine al moto dei corpi celesti. Dal lato della biologia, siamo affascinati dalla delicatezza impalpabile e cangiante delle modulazioni fini che si integrano nella regolazione del battito cardiaco senza che nessuna prenda il sopravvento sull’altra mantenendo l’attività del cuore insieme stabilissima (una pompa che pulsa approssimativamente una volta al secondo senza interruzioni per novanta e più anni) e imprevedibile (la durata di ogni singolo battito è una variabile stocastica).
 Se la biologia e la fisica fossero dei paesaggi naturali sarebbero una scogliera a picco sul mare ed una vetta altissima, Capri e Courmayeur, due estremi, appunto. La chimica sarebbe invece il dolce paesaggio collinare delle Marche o della Toscana, la bellezza non si presenterebbe qui nelle forme dell’estremo ma in quelle dell’armonia e della perfetta compenetrazione delle parti. La chimica è scienza intermedia e quindi inusitatamente profonda.
Se la biologia e la fisica fossero dei paesaggi naturali sarebbero una scogliera a picco sul mare ed una vetta altissima, Capri e Courmayeur, due estremi, appunto. La chimica sarebbe invece il dolce paesaggio collinare delle Marche o della Toscana, la bellezza non si presenterebbe qui nelle forme dell’estremo ma in quelle dell’armonia e della perfetta compenetrazione delle parti. La chimica è scienza intermedia e quindi inusitatamente profonda.
Alcuni tratti accomunano la chimica alla biologia, e non a caso la biochimica, cioè lo studio dei costituenti chimici degli organismi viventi, è alla base di ogni “spiegazione quantitativa” del mondo biologico. Altri aspetti la rendono simile alla fisica, L’opera che forse rende più mirabile la chimica, espressione del particolarissimo “genio chimico”, è la Tavola Periodica degli Elementi, che prende il nome di Dimitrij Mendeleev (1834-1907), insieme fondamento e verifica della congruità della fisica moderna.
Da un punto di vista stilistico la chimica, scienza intermedia per eccellenza, condivide con la biologia l’interesse per la classificazione, per la ricerca dei “nomi naturali”, delle “entità discrete” che meglio rappresentino il mondo; con la fisica invece condivide la tendenza alla rappresentazione modellistica “esatta” degli oggetti microscopici studiati e l’estrema importanza assegnata agli strumenti ed ai metodi di misura.
Questi due punti di vista stilistici si compenetrano in quel particolarissimo linguaggio simbolico che sono le formule di struttura. Il concetto di struttura riveste un ruolo cruciale nella chimica; a differenza della fisica, dove la struttura è vista come un concetto geometrico, la chimica considera la struttura in termini topologici, dove ciò che conta non sono le dimensioni o la posizione nello spazio degli enti ma le loro relazioni reciproche. Per questo la chimica è stata (ed è tuttora) la prima scienza sistemica e concetti che sembrano nuovi e dirompenti per le sorelle “estreme” (fisica e chimica) come ragionare per reti di relazioni, sono tranquillamente inseriti nella chimica almeno dal 1861 quando il chimico russo Alexandr Butlerov (un collaboratore di Dimitrij Mendeleev) diede la prima articolazione esplicita della formula di struttura che è un mirabile ed ancora insuperato esempio di grafo o network che dir si voglia.
Quando in una lezione di chimica il professore scrive alla lavagna la formula dell’alcool metilico o metanolo:
CH3—OH
egli sta in effetti disegnando una forma ultra-semplificata di grafo in cui esplicitamente mette l’accento sulla presenza di due “cluster di nodi” rilevanti: (CH3), il gruppo “metile”, e il gruppo ossidrile (OH) e, ponendo un trattino fra di loro, indicante un legame chimico, dice che la molecola risultante è considerabile come una unione fra queste due entità. In questa unione gli elementi (C, O, H: carbonio, ossigeno ed idrogeno) rinunciano in parte alla loro individualità per ereditare delle caratteristiche “sistemiche”: ogni chimico per esempio sa bene che l’idrogeno dell’acqua è diverso (per esempio è più acido) di quello del metano. La formula del metanolo allora evoca una serie di informazioni implicite legate al particolare comportamento delle specie alcoliche (un alcool è una sostanza organica avente uno o più gruppi ossidrili), alla maggiore o minore probabilità di certe reazioni chimiche e così via. Queste informazioni sono a loro volta evocate anche dal nome “alcool metilico” e “metanolo” permettendo, con un certo allenamento, di passare dalla rappresentazione simbolica al “nome naturale” delle specie e viceversa con grande facilità. La formula di struttura non si limita ad evocare una quantità di informazioni qualitative sulla molecola in questione ma, quando usata come input di opportuni algoritmi, permette di ricavare una messe di informazioni quantitative sulla molecola stessa che vanno da grandezze quanto-meccaniche al peso molecolare, alla relativa solubilità in solventi acquosi o apolari, al comportamento in un campo elettromagnetico. Queste informazioni, quando raccolte per un insieme omogeneo di molecole (le cosiddette serie chimiche) e studiate con opportune tecniche statistiche, permettono in molti casi di prevedere l’attività sui sistemi biologici delle molecole stesse consentendo quindi un ardito ma robusto “ponte” tra la fisica e la biologia. Le formule sono insomma dei “simboli attivi”, simboli (dal greco sym-ballo, “raccolgo insieme”) che non solo racchiudono ma rendono poi disponibili le informazioni sull’ente rappresentato, sono le frasi di un linguaggio intriso di senso lontano mille miglia da ogni codifica convenzionale.
Alla base di questo miracolo linguistico vi è la possibilità di conoscere con esattezza le lettere dell’alfabeto, cioè i costituenti elementari da combinare per la costruzione dei simboli. Proprio qui incontriamo quel capolavoro assoluto che è la Tavola Periodica degli Elementi la cui definizione si deve principalmente al chimico russo Dimitrij Ivanovic Mendeleev.
Nato a Tobol’sk nel 1834, suo padre era preside del ginnasio cittadino, ma proprio nell’anno in cui nacque il futuro scienziato, dovette lasciare il suo incarico per aver perso la vista a causa di una cataratta. La madre, donna di grande energia, si assunse il peso di mantenere ed educare i numerosi figli, ben 17, occupandosi della direzione di una vetreria che apparteneva al fratello, divenendo l’unica fonte di reddito della famiglia Mendeleev. La madre aveva una grandissima fiducia nelle capacità del figlio Dimitrij e, dopo la conclusione del ginnasio, volle mandarlo a studiare all’università di S.Pietroburgo. Dopo essersi iscritto alla facoltà di matematica e fisica ed in seguito essersi occupato di zoologia, Dimitrij si volse definitivamente alla scienza chimica (di nuovo questa medietà della chimica). Nel 1855 Mendeleev terminò gli studi e iniziò a insegnare, prima nei licei e poi all’università. Nel 1859 si recò in Germania per perfezionare la sua preparazione scientifica. Qui avvenne l’incontro con lo scienziato italiano Stanislao Cannizzaro i cui studi indirizzarono Mendeleev alla creazione della Tavola Periodica degli Elementi. Fu infatti Cannizzaro a sottolineare l’importanza del peso atomico per determinare le proprietà fisiche e chimiche degli elementi, principio basilare nella classificazione periodica di Mendeleev.
Ma procediamo con ordine, la scienza chimica antica ha sempre fatto riferimento a pochi “elementi” non ulteriormente suddivisibili da cui derivare tutte le altre sostanze naturali, i più noti sono i quattro elementi individuati da Empedocle ed Aristotele come acqua, aria, terra e fuoco. Con Antoine-Laurent de Lavoisier (1743-1794), il fondatore della chimica moderna, il numero degli elementi passa a trentatre e, per la prima volta, si fornisce una esplicita definizione operativa di elemento legata alle tecniche con cui ottenerne la separazione. Nel Traitè Elementaire de Chimie, del 1789, Lavoisier scriveva «se con il termine elementi vogliamo indicare gli atomi semplici e indivisibili di cui è costituita la materia, allora è molto probabile che non sappiamo nulla di essi; ma se usiamo il termine elementi o principi dei corpi, per esprimere la nostra idea del limite con cui possiamo arrivare con la nostra analisi, allora dobbiamo includere fra gli elementi tutte le sostanze in cui siamo capaci di scomporre con qualsiasi mezzo, i corpi».
Lavoisier continua dicendo che la sua definizione, essendo legata alla capacità tecniche di analisi in un certo momento storico, non può aspirare ad essere in alcun modo conclusiva, per cui non possiamo escludere che delle sostanze che ci appaiono semplici perché non siamo in grado di scomporle ulteriormente non siano in realtà dei composti. Notiamo come Lavoisier sia conscio di due livelli della chimica: quello macroscopico (le sostanze) scientificamente indagabile e quello microscopico (gli atomi) per la scienza dell’epoca esclusivamente ipotetico e quindi al di fuori dell’indagine empirica. Sarà Dalton, e ancor meglio il chimico torinese Amedeo Avogadro (1776-1856) che, con la sua definizione di mole che identificava correttamente i rapporti tra peso atomico e numero di particelle, alcuni anni dopo, riunirà i due piani di spiegazione introducendo il concetto di valenza, che consente di accedere (anche se indirettamente) al livello microscopico di spiegazione osservando le proporzioni relative delle sostanze semplici che si combinano per dar vita a sostanze composte. A Lavoisier rimane però il merito di aver introdotto una “dimensione” nuova nelle scienze: gli elementi non erano né una quantità inusitata e innumerabile (virtualmente infiniti, come le specie viventi ad esempio), né tre o quattro (come gli stati di aggregazione della materia); di nuovo possiamo apprezzare questa “medietà” della chimica con la contemporanea attenzione alla definizione operativa, rigorosa dei suoi oggetti in termini operativi, e alla classificazione accurata.
La necessità di mettere ordine all’interno degli elementi chimici apparve impellente intorno alla metà dell’Ottocento quando l’elenco si arricchì di molti nuovi arrivi mentre nel frattempo si andava accumulando un gran numero di dati relativi alle proprietà chimiche e fisiche degli elementi che erano già stati isolati. Nel 1830 si conoscevano più di 50 elementi diversi e ci si chiedeva quanti ne rimanessero da scoprire. Gli elementi erano forse in numero infinito? Individuare un metodo per ordinarli in funzione delle loro caratteristiche peculiari forse avrebbe consentito anche la determinazione del loro numero.
Questo è un punto cruciale e denota il precoce atteggiamento “sistemico” della scienza chimica: un ordinamento delle proprietà degli elementi chimici che avesse seguito un “criterio costruttivo” (un matematico parlerebbe di una definizione intensionale dell’insieme degli elementi piuttosto che estensionale) avrebbe permesso di immaginare a priori (prima perciò di isolarli effettivamente) il numero degli elementi esistenti. Questo principio (che a ben vedere ha un fondamento puramente estetico, assimilabile alla definizione della scala cromatica in musica come “accordi ben formati”) fu così efficace che il Sistema Periodico (o Tavola) degli elementi chimici definita centocinquanta anni fa, nonostante l’opera abbia subito aggiustamenti e miglioramenti, ha mantenuto intatta la struttura originaria. Nemmeno le due teorie fondamentali del XX secolo, ossia la relatività di Albert Einstein e la meccanica quantistica di Max Planck, sono valse ad intaccare le basi strutturali dello schema elaborato dal suo ideatore.
Classificare gli elementi avrebbe voluto dire fra l’altro fare emergere nuove proprietà e chiarire il motivo per il quale, ad esempio, certi elementi realizzano determinate combinazioni e certi altri non si combinano affatto.
Fra i primi scienziati che tentarono di mettere ordine fra gli elementi noti vi fu il chimico tedesco Johann Wolfgang Döbereiner (1780-1849). Egli nel 1828 aveva osservato che il bromo, un elemento scoperto due anni prima, era dotato di proprietà che sembravano essere intermedie fra quelle del cloro e quelle dello iodio. Non solo si notava in questi tre elementi una graduale variazione di alcune proprietà come il colore e la reattività, ma si era osservato anche che il peso atomico del bromo si trovava a metà strada fra quello del cloro e quello dello iodio. Poteva trattarsi di una coincidenza? Döbereiner andò alla ricerca di altri gruppi di tre elementi le cui proprietà si disponessero secondo una variazione regolare e in effetti notò che si assomigliavano fra loro anche litio, sodio e potassio, elementi detti metalli alcalini perché presenti in composti chiamati alcali (sostanze con proprietà opposte a quelle degli acidi); così pure si assomigliavano magnesio, calcio e stronzio, detti metalli alcalino-terrosi in quanto i loro ossidi (un tempo detti terre) avevano anch’essi proprietà alcaline; cloro, bromo e iodio, sono detti alogeni (dal greco: “generatori di sali”) perché si combinano direttamente con alcuni metalli generando sali, come ad esempio il cloruro di sodio (il comune sale di cucina). Döbereiner propose allora la “teoria delle triadi” ma non essendo stato in grado di rinvenire altri gruppi di tre elementi con caratteristiche simili, dovette rinunciare alla teoria così come era stata formulata. Notiamo come già in questo primo tentativo di classificazione l’idea fosse immaginare una classificazione efficace come una classificazione regolare, armonica, in cui gli elementi si susseguissero in una serie “generativa”.
Dopo questo ed altri infruttuosi tentativi, ci si rese conto che sperare di mettere ordine fra gli elementi era illusorio, in quanto vi era molta confusione relativamente ai loro pesi e al numero degli atomi presenti all’interno dei composti tanto che, spesso per uno stesso composto, venivano proposte formule del tutto diverse. Per fare chiarezza sull’argomento si decise allora di organizzare una conferenza di chimici di tutta Europa. Nel 1860 fu pertanto indetto, per la prima volta nella storia della scienza, un convegno internazionale che prese il nome di Primo Congresso Chimico Internazionale e si tenne a Karlsruhe in Germania. Vi presero parte circa centotrenta delegati; la relazione che ebbe maggior successo fu quella di Stanislao Cannizzaro, professore di chimica presso l’ Università di Genova, il quale difese il principio di Avogadro che lui stesso utilizzava per determinare il peso atomico degli elementi con risultati che si erano dimostrati estremamente precisi. Alla fine del congresso, quando i chimici si accingevano a tornare ai loro paesi nello stesso stato di confusione di idee di quando erano arrivati, Cannizzaro distribuì le dispense che utilizzava durante il corso di chimica che teneva a Genova. In esse erano espressi chiaramente i risultati a cui si sarebbe pervenuti accettando l’ipotesi di Avogadro nella sua totalità. «Fu come se un velo mi fosse calato dagli occhi – commentò il chimico tedesco Julius Lothar Meyer (1830-1895) – sparirono in me tutte le incertezze e al loro posto subentrava la chiarezza piena di armonia».
In seguito ai risultati scaturiti dal Congresso di Karlsruhe il chimico inglese J.A. Reina Newlands (1837-1898) propose un sistema di classificazione basato sul peso atomico. Egli, disponendo gli elementi per peso atomico crescente, aveva notato che, con cadenza regolare, ad ogni otto di essi si ripetevano proprietà simili. Newlands, che aveva avuto un’educazione musicale, chiamò questa relazione “Legge delle ottave” per analogia con la scala musicale in cui l'ottava nota dà una percezione simile alla prima. Disponendo gli elementi in colonne verticali di sette unità quelli simili si venivano a trovare sistemati sulle stesse righe orizzontali. Il potassio, ad esempio, veniva a trovarsi vicino al sodio, il cloro cadeva sulla stessa riga di bromo e iodio e il magnesio si sistemava a fianco del calcio. In altre parole, le triadi scoperte da Döbereiner si posizionavano spontaneamente su righe orizzontali. La sua proposta però venne accolta con scetticismo, da qualcuno addirittura ridicolizzata, e alla fine fu scartata. Qualche cosa di simile aveva suggerito un paio d’anni prima il geologo francese Alexandre-Émile Béguyer de Chancourtois, ma anche la sua classificazione, rappresentata con un grafico a spirale tracciato sulla superficie di un cilindro, passò inosservata. Tali classificazioni contenevano invece il germe del criterio ordinatore che in seguito si sarebbe dimostrato quello giusto e infatti, molti anni più tardi, quando la Tavola Periodica di Mendeleev sarà universalmente accettata, i lavori del geologo francese e del chimico inglese ebbero riconoscimento ufficiale.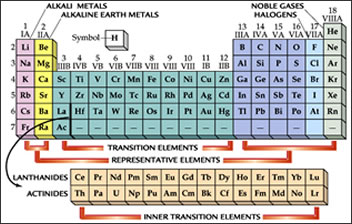
I tempi erano comunque maturi e l’idea “musicale” di simmetria era quella giusta; occorreva però attendere un animo realmente e profondamente musicale come quello di Mendeleev per arrivare, nel 1869, alla soluzione. Il legame con la musica dell’ambiente chimico russo era infatti fortissimo, Aleksandr Porfirevic Borodin (1833-1887), ai nostri giorni noto come uno dei più grandi compositori di musica ottocenteschi (tra l’altro ampiamente saccheggiato da Broadway, come nella struggente “Stranger in Paradise”, ripresa dalle sue Danze Polovesiane), era un valente chimico organico (ancora studiate sono le sue reazioni di condensazione delle aldeidi) e stretto collaboratore di Mendeleev. A casa di Dimitrij Ivanovic era solito riunirsi il cosiddetto gruppo dei cinque (Borodin, Rimsky-Korsakov, Mussorgski, Balakirev, Cui), ovvero i compositori che diedero vita ad una tradizione musicale russa moderna indipendente dalla tradizione classica occidentale.
Il punto di partenza di Mendeleev è squisitamente armonico in quanto si fonda sulle regole di composizione degli elementi (note) per formare accordi “consonanti” (composti), il punto di partenza è insomma la valenza che il chimico russo utilizza, invece del peso, come criterio ordinatore. La valenza (dal latino “forza”) ai tempi di Mendeleev veniva definita genericamente come il potere di combinazione degli atomi. Poiché si era osservato che l'atomo di idrogeno non si combinava mai con più di un solo atomo di un qualsiasi altro elemento, all'idrogeno venne assegnata, per convenzione, valenza uno.
Se ora, l'analisi ponderale attribuiva ad esempio al solfuro di idrogeno la formula H2S, voleva dire che lo zolfo (S) esplicava valenza 2, in quanto tale elemento risultava combinato con due atomi di idrogeno. Allo stesso modo, dalla conoscenza della formula dell'acqua, H2O, appariva evidente la valenza 2 dell'ossigeno.
Per gli elementi che non davano composti con l'idrogeno la valenza veniva stabilita per via indiretta, in base alla capacità di sostituirsi o di equivalere ad atomi di idrogeno. Ad esempio, dalla formula CaS risultava evidente la valenza 2 del calcio (Ca), perché si poteva immaginare che nella formazione del composto un suo atomo avesse sostituito i due atomi di idrogeno in H2S. Potremmo quindi dare la seguente definizione di valenza valida per quei tempi: "Valenza di un elemento è il numero degli atomi di idrogeno con cui quell'elemento si combina o a cui si sostituisce per formare un composto." L'esperienza, inoltre, metteva in luce che un elemento poteva possedere valenza diversa in composti diversi. Nel composto SO3, ad esempio, lo zolfo esplicava valenza 6, mentre nel composto SO2 lo zolfo presentava valenza 4. Fu chiamata “valenza limite” la valenza massima che un elemento poteva presentare nei diversi composti a cui prendeva parte.
Disponendo gli elementi in funzione del loro peso atomico crescente, Mendeleev notò che si venivano a formare spontaneamente, ad intervalli fissi e ricorrenti, gruppi di essi con proprietà chimiche e fisiche comuni. Nell'organizzare il suo Sistema Periodico, egli procedette con un metodo empirico basato sulla “ricerca delle consonanze”. Escludendo l'idrogeno, l'elemento più leggero, che non dimostrava somiglianze con alcun altro, Mendeleev ordinò, per peso atomico crescente, i sette elementi successivi, a quel tempo noti: litio, berillio, boro, carbonio, azoto, ossigeno e fluoro. Questi elementi mostravano una graduale variazione delle proprietà chimiche e fisiche (erano cioè “ben ordinati”); in particolare variava gradualmente la valenza limite relativamente ai composti binari con l'idrogeno e con l'ossigeno. Per i composti con l'idrogeno si constatava che la valenza andava progressivamente aumentando da 1 a 4 per poi ridiscendere fino ad 1. I composti idrogenati presentavano pertanto le seguenti formule: LiH, BeH2, BH3, CH4, NH3, H2O, HF. Per i composti con l'ossigeno non si riscontrava invece la stessa regolarità; la valenza limite in questo caso cresceva fino a 5 (Li2O, BeO, B2O3, CO2, N2O5), ma poi l'ossigeno e il fluoro presentavano rispettivamente la bi- e la mono-valenza (valenza 2 e 1).
Dopo questi primi sette elementi seguivano, in ordine di peso atomico crescente, sodio, magnesio, alluminio, silicio, fosforo, zolfo e cloro. Anche per questi elementi si assisteva ad una variazione graduale della valenza limite, e in maniera ancora più marcata che per il gruppo precedente. Infatti, mentre per i composti con l'idrogeno si ripetevano le valenze già viste, per i composti con l'ossigeno la valenza aumentava regolarmente da 1 a 7 in quanto gli ultimi due elementi, zolfo e cloro, mostravano rispettivamente la valenza 6 e 7 che non si riscontrava in ossigeno e fluoro. Inoltre, e questo è il fatto più significativo, ciascuno di questi sette elementi, presentava proprietà molto simili al corrispondente elemento dell'insieme dei primi sette con cui era stato incolonnato.
Dopo il cloro si susseguivano, al tempo di Mendeleev, potassio, calcio, titanio, vanadio, cromo e manganese. I primi due si incolonnavano naturalmente nel primo e nel secondo gruppo di elementi, cioè rispettivamente sotto i metalli alcalini litio e sodio e sotto gli alcalino-terrosi berillio e magnesio; il titanio, invece, non presentava alcuna analogia con il boro e l'alluminio che erano, tra l'altro, trivalenti, mentre il titanio presentava valenza 2 e 4; le proprietà del titanio erano invece analoghe a quelle di carbonio e silicio. Mendeleev interpretò tale discordanza ammettendo l'esistenza di un elemento ancora sconosciuto, che egli provvisoriamente chiamò eka-boro (eka è un termine che deriva dal sanscrito e vuole dire "primo"), che doveva trovare sede nel terzo gruppo, insieme a boro e alluminio, e che avrebbe dovuto possedere le caratteristiche tipiche degli elementi di quel gruppo. Quindi incolonnò il titanio sotto il silicio, il vanadio sotto il fosforo, il cromo sotto lo zolfo e il manganese sotto il cloro.
Si noti, a questo punto, come la valenza limite stia diventando determinante al fine di stabilire la posizione dell'elemento nel sistema. Si osservi inoltre che la rappresentazione si andava configurando suddivisa in periodi orizzontali e in gruppi verticali, in modo tale che la valenza massima di ogni elemento corrispondesse al numero del gruppo in cui l'elemento stesso aveva trovato sistemazione.
Dopo il manganese seguivano, sempre in ordine di peso atomico crescente, ferro, nichel, cobalto, rame, zinco, arsenico, selenio e bromo. A questo punto Mendeleev notò che cessava quella graduale variazione di proprietà che si era riscontrata in precedenza passando da un elemento ad un altro. La triade ferro, nichel e cobalto presentava, ad esempio, caratteristiche fisiche e chimiche tanto simili da indurre il chimico russo a sistemarli tutti e tre in un'unica casella, dopo il manganese, inaugurando, in questo modo, un'ottava colonna. Lo studio accurato di questi tre elementi e dei loro composti lo indusse inoltre ad invertire di posto nichel e cobalto, sistemando nell'ottava colonna i tre elementi nel seguente ordine: ferro, cobalto e nichel. Pose successivamente il rame nella prima colonna, anche se in realtà le caratteristiche di questo elemento erano molto lontane da quelle dei metalli alcalini, ma lo fece confortato dal fatto che esso presentava la monovalenza (oltre alla valenza 2). In realtà una simile discrepanza si era già osservata per alcuni elementi precedenti e precisamente dal titanio in poi, tanto che Mendeleev ritenne opportuno spostare leggermente detti elementi dall'incolonnamento, sdoppiando in pratica ciascun gruppo in due sottogruppi. Siccome la stessa cosa avveniva anche per lo zinco, alla fine lo spostamento complessivo risultò di 10 elementi (includendo anche quello sconosciuto): ad essi fu dato il nome di elementi di transizione. Applicando i criteri fin qui seguiti, non era difficile procedere alla sistemazione dei restanti elementi.
Mendeleev non sapeva nulla sulla costituzione intima dell'atomo. Tuttavia, ordinando gli elementi secondo le loro caratteristiche chimiche, egli inconsapevolmente suggeriva che l'atomo non poteva considerarsi un semplice blocchetto di materia inerte, ma doveva possedere una struttura interna ordinata, poiché solo in questo modo si potevano giustificare le variazioni graduali delle proprietà chimiche e fisiche degli elementi al crescere del loro peso. Per esempio, litio, sodio e potassio, che stanno su righe diverse, ma nella stessa colonna, hanno proprietà simili, che non possono essere spiegate appellandosi semplicemente al crescere del loro peso.
Un'ulteriore dimostrazione della validità del lavoro di Mendeleev fu rappresentata dalla scoperta dei primi due gas nobili: elio e argo. Fu possibile, in quell'occasione, prevedere l'esistenza di altri elementi simili in quanto il Sistema Periodico risultava strutturato in modo tale da accogliere l'inserzione di tutto un gruppo di elementi inerti, quali erano elio ed argo, senza perturbare l'ordine già definito. I gas nobili o gas rari sono sei (elio, neo, argo, kripto, xeno e radon) e trovarono sistemazione naturale in un'ultima colonna opportunamente aggiunta: il gruppo zero.
Ma ciò che più ci colpisce del Sistema Periodico è che il modello atomico di Niels Bohr (stiamo ormai parlando degli anni dieci del Novecento), basato sulla distanza fra le righe spettrali di emissione degli elementi chimici, è perfettamente previsto (e trova a sua volta conferma) dalla sistemazione di Mendeleev. Nei decenni successivi, i “vuoti” della tavola previsti dal grande scienziato russo hanno progressivamente trovato posto (con minimi aggiustamenti) all’interno della sua costruzione concettuale.
In questi tempi di esperimenti estremi alle stesse condizioni del Big Bang, in cui da una parte sembra non si riesca a scoprire nulla se prima non si conosca l’elenco completo degli attori coinvolti in un certo fenomeno, e dall’altra l’elaborazione teorica sembra poter avvenire solo come conseguenza di uno sforzo colossale di mezzi, denaro e personale, la storia della Tavola Periodica degli Elementi svolge un ruolo importantissimo: ci riporta alla necessità del perseguimento della bellezza da parte dell’animo creativo del singolo scienziato, come qualcosa che permette un reale avanzamento, senza aspettare di “sapere già tutto” per avventurarsi nella scoperta. La Tavola Periodica ci riporta insomma all’importanza dell’immaginazione (e forse meno a quella dei fondi di ricerca) come primo motore della scienza.